A MEF2D rendezetlen ß-alegységének dinamikai vizsgálata
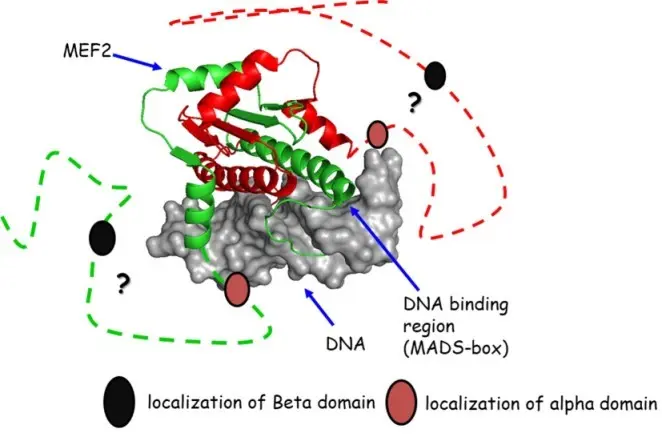
A MEF2D transzkripciós faktor fontos szerepet játszik az izomsejtek differenciációs folyamataiban. Alternatív hasítással szabályozott ß-alegysége még a kötött állapotában is rendezetlen, elmosódott (bolyhos) szerkezetű. Fuxreiter Mónika professzorasszony sejtes kísérletei megmutatták, hogy mutációkkal változtathatók a dinamikai tulajdonságok, mellyel a biológiai hatás is finomhangolható. Kutatócsoportunk a ß-alegység egy kötörégióját modellező peptidek dinamikai összehasonlítását végzi NMR-módszerekkel (relaxáció, diffúzió, másodlagos kémiai eltolódások) és in silico molekuladinamikai számításokkal.
A képen: a MEF2A-DNS komplex NMR-szerkezete (PDB: 1C7U)
UV-érzékeny ciklikus peptidek szerkezetvizsgálata
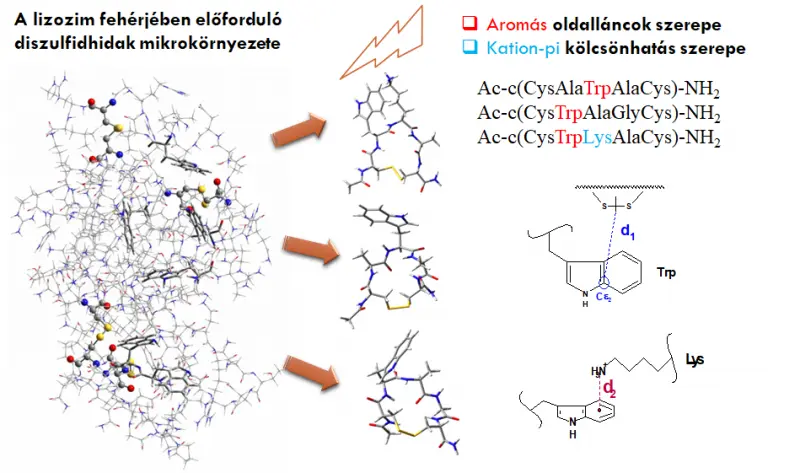
A fehérjékben található diszulfidkötések felelősek a biológialiag aktív szerkezet fenntartásáért. Közeli UV-fény hatására azonban könnyen felhasadhatnak, ez pedig könnyen befolyásolhatja a fehérje élő szervezetben betöltött aktivitását, szerepét. A diszulfidhidak stabilitását meghatározza azoknak kémiai környezete (aromás oldalláncok, kromofórok közelsége, stabilizáló kölcsönhatások, dinamika), melyet Dr. Majer Zsuzsával való együttműködésünk során vizsgálunk. Kutatócsoportunk felderíti diszulfidhíddal ciklizált peptidmodellek konformációs és dinamikai sajátságait NMR-szerkezetszámítással és molekuladinamikai szimulációkkal.
Gróf P. , Knapp K., Schlosser G., Nagy T.M., Timári I., Borics A., Kövér K., Csík G., Majer Zs.:
Diszulfidhidat tartalmazó ciklikus peptidek UV-besugárzásának hatására keletkező szabadgyökök és szulfhidril-csoportok detektálása
MAGYAR TUDOMÁNY 177:(1) pp. 50-54. (2016)
T. M. Nagy, K. Knapp, E. Illyés, I. Timári, G. Schlosser, G. Csík, A. Borics, Zs. Majer, K.E. Kövér
Photochemical and Structural Studies on Cyclic Peptide Models
MOLECULES 23:(9) Paper 2196. 20 p. (2018)
Projekt a researchgate-en.